 |
| ||||||
Ogólnie...
Ładowanie
Więcej o Batscan...
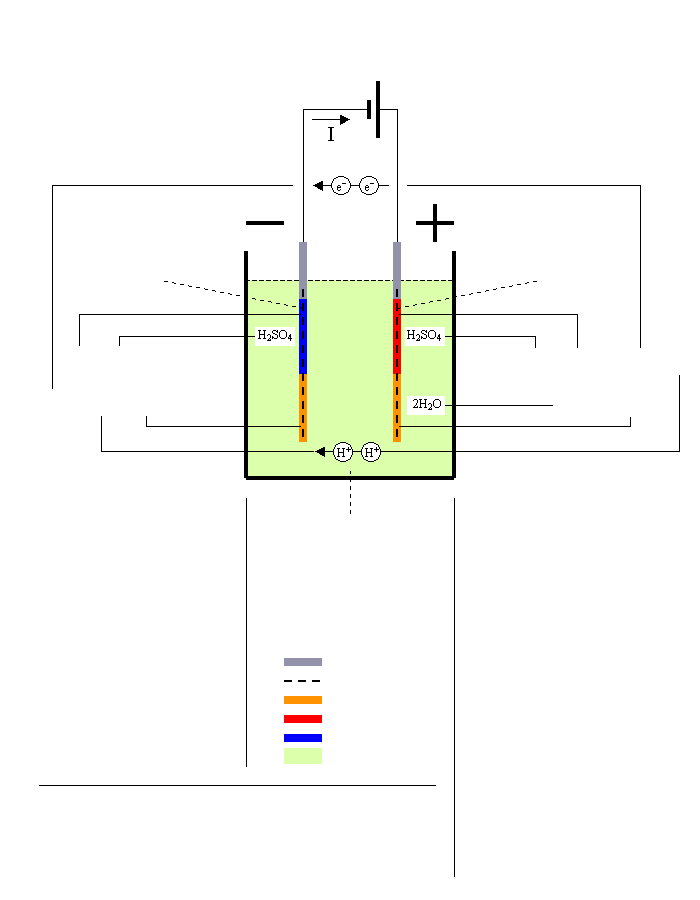
Ładowanie akumulatorów ołowiowych
Źródło prądu stałego
Płytka ujemna = Katoda
PbSO4 → Pb
Siarczan Pb → Gąbka Pb
PbSO4 → Pb
Siarczan Pb → Gąbka Pb
Pb + H2SO4
↑
[2e-] + 2H+ + PbSO4
↑
[2e-] + 2H+ + PbSO4
Reakcja przy biegunie -
(Redukcja)
(Redukcja)
| 1. |
Dwa dodane elektrony [2e-] zmniejszają zaw. siarczanu ołowiu który dzieli sie
na atom ołowiu i jon siarczanu: [2e-] + PbSO4 → Pb + SO42- |
| 2. |
jon siarczanu [1] łączy się z jonami wodoru [5] tworząc kwas siarkowy: 2H+ + SO42- → H2SO4 |
Elektrolit = Kwas siarkowy
H2O → H2SO4
Woda → Kwas siarkowy
H2O → H2SO4
Woda → Kwas siarkowy
Elektrody Pb
Płytka perf.
Siarczan Pb
Tlenek ołowiu
Gąbczasty Pb
Elektrolit
Płytka perf.
Siarczan Pb
Tlenek ołowiu
Gąbczasty Pb
Elektrolit
Reakcja netto przy ładowaniu
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
2Siarczan Pb+2Woda → Gąbka Pb+Dwutlenek Pb+2Kwas siarkowy
(energia elektryczna → energia chemiczna)
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
2Siarczan Pb+2Woda → Gąbka Pb+Dwutlenek Pb+2Kwas siarkowy
(energia elektryczna → energia chemiczna)
Płytka dodatnia = Anoda
PbSO4 → PbO2
Siarczan Pb → Dwutl. Pb
PbSO4 → PbO2
Siarczan Pb → Dwutl. Pb
H2SO4 + PbO2 + [2e-] + 2H+
↑
2H2O + PbSO4
↑
2H2O + PbSO4
Reakcja przy biegunie +
(Utlenianie)
(Utlenianie)
| 3. |
Oddanie dwóch elektronów [2e-] utlenia siarczan ołowiu, który wtedy dzieli się
na jon ołowiu(IV) i jon siarczanu: PbSO4 → [2e-] + Pb4+ + SO42- |
| 4. |
Jon siarczanu rozpuszcza się w wodzie tworząc kwas siarkowy uwalniając jednocześnie jon tlenu: SO42- + H2O → H2SO4 + O2- |
| 5. |
Jon ołowiu z[3] łączy sie z jonem tlenu z [4] i atomem tlenu z wody,
przyczym dwa jony wodoru uwalniane są do elektrolitu: |
|
Pb4+ + O2- + H2O → PbO2 + 2H+ |
|