 |
| ||||||
Ogólnie...
Rozładowanie
Więcej o Batscan...
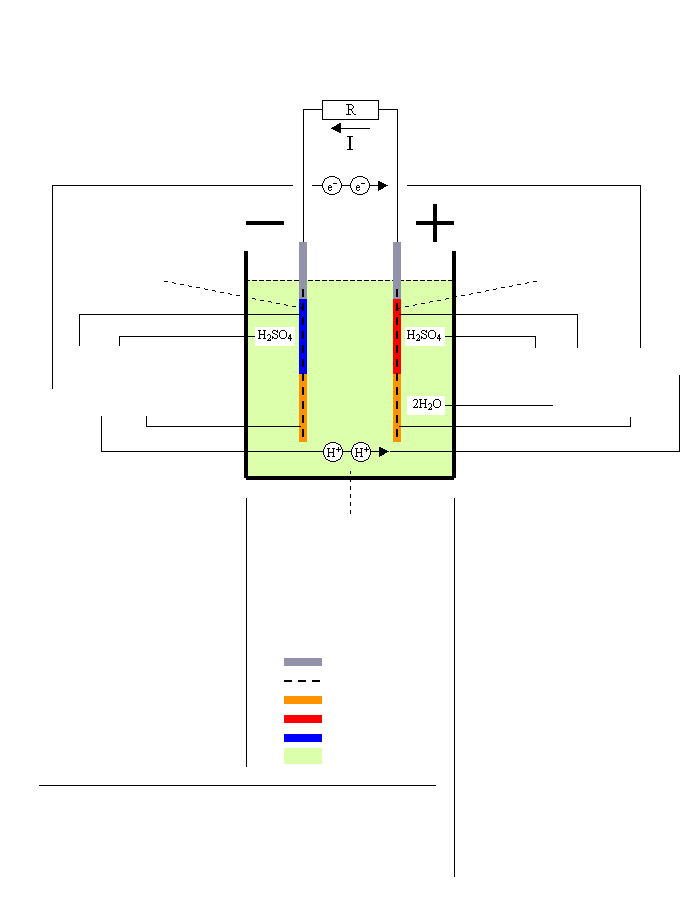
Rozładowanie akumulatora ołowiowego
Opór
Płytka ujemna = Anoda
Pb → PbSO4
Gąbka Pb → Siarczan Pb
E0 = -0.356V
Pb → PbSO4
Gąbka Pb → Siarczan Pb
E0 = -0.356V
Pb + H2SO4
↓
[2e-] + 2H+ + PbSO4
↓
[2e-] + 2H+ + PbSO4
Reakcja przy biegunie -
(Utlenianie)
(Utlenianie)
| 1. |
Przez oddanie dwóch elektronów [2e-] ołów utlenia się zmieniajac ładunek na dodatni: Pb → [2e-] + Pb2+ |
| 2. |
Dodatnio naładowane atomy ołowiu reagują z kwasem siarkowym uwalniając dwa jony wodoru do elektrolitu: Pb2+ + H2SO4 → PbSO4 + 2H+ |
Elektrolit = Kwas siarkowy
H2SO4 → H2O
Kwas siarkowy → Woda
H2SO4 → H2O
Kwas siarkowy → Woda
Elektrody Pb
Płytka perf.
Siarczan ołowiu
Dwutlenek ołowiu
Gąbczasty ołów
Elektrolit
Płytka perf.
Siarczan ołowiu
Dwutlenek ołowiu
Gąbczasty ołów
Elektrolit
Reakcja rozładowania
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
Gąbka Pb + Dwutlenek Pb + 2Kwas solny → 2Siarczan Pb + 2Woda
(Energia chemiczna → Energia elektryczna)
E = 2.041V
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
Gąbka Pb + Dwutlenek Pb + 2Kwas solny → 2Siarczan Pb + 2Woda
(Energia chemiczna → Energia elektryczna)
E = 2.041V
Płytka dodatnia = Katoda
PbO2 → PbSO4
Dwutlenek Pb → Siarczan Pb
E0 = +1.685V
PbO2 → PbSO4
Dwutlenek Pb → Siarczan Pb
E0 = +1.685V
H2SO4 + PbO2 + [2e-] + 2H+
↓
2H2O + PbSO4
↓
2H2O + PbSO4
Reakcja przy biegunie +
(Rozpad)
(Rozpad)
| 3. |
Dodane dwa elektrony [2e-] dzielą dwutlenek ołowiu na jon ołowiu(II)
i dwa jony tlenu: [2e-] + PbO2 → Pb2+ + 2O2- |
| 4. |
Jon ołowiu z [3] reaguje z kwasem siarkowym tworząc siarczan ołowiu i uwalniając dwa jony wodoru: Pb2+ + H2SO4 → PbSO4 + 2H+ |
| 5. |
Jony wodoru z [2] i [4] łączą sięz jonami tlenu [3] tworząc dwie molekuły wody: 2H+ + 2H+ + 2O2- → 2H2O |