 |
| ||||||
Allmänt om...
Urladdning
Mer om Batscan...
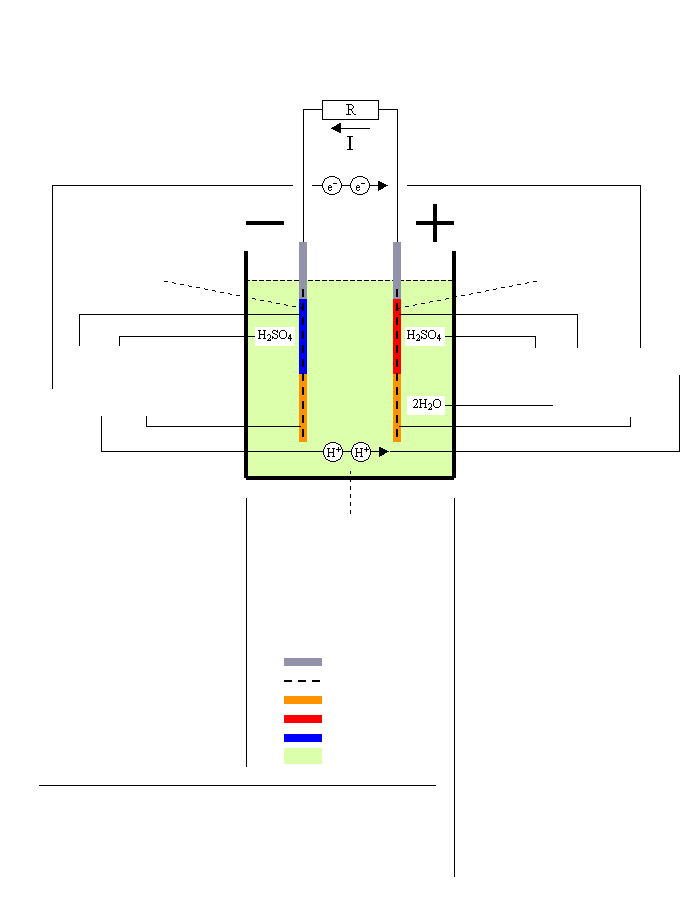
Urladdning av Bly-Syra Batteri
Resistans
Negativ platta = Anod
Pb → PbSO4
Blysvamp → Blysulfat
E0 = -0.356V
Pb → PbSO4
Blysvamp → Blysulfat
E0 = -0.356V
Pb + H2SO4
↓
[2e-] + 2H+ + PbSO4
↓
[2e-] + 2H+ + PbSO4
Reaktion vid -pol
(Oxidation)
(Oxidation)
| 1. |
Genom bortledande av två elektroner [2e-] oxideras blyet som då får en positiv laddning: Pb → [2e-] + Pb2+ |
| 2. |
Den positivt laddade blyatomen reagerar med svavelsyran och bildar blysulfat varvid två vätejoner frigörs till elektrolyten: Pb2+ + H2SO4 → PbSO4 + 2H+ |
Elektrolyt = Svavelsyra
H2SO4 → H2O
Svavelsyra → Vatten
H2SO4 → H2O
Svavelsyra → Vatten
Blyelektroder
Gallerplatta
Blysulfat
Blydioxid
Blysvamp
Elektrolyt
Gallerplatta
Blysulfat
Blydioxid
Blysvamp
Elektrolyt
Nettoreaktion vid urladdning
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
Blysvamp + Blydioxid + 2Svavelsyra → 2Blysulfat + 2Vatten
(kemisk energi → elektrisk energi)
E = 2.041V
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
Blysvamp + Blydioxid + 2Svavelsyra → 2Blysulfat + 2Vatten
(kemisk energi → elektrisk energi)
E = 2.041V
Positiv platta = Katod
PbO2 → PbSO4
Blydioxid → Blysulfat
E0 = +1.685V
PbO2 → PbSO4
Blydioxid → Blysulfat
E0 = +1.685V
H2SO4 + PbO2 + [2e-] + 2H+
↓
2H2O + PbSO4
↓
2H2O + PbSO4
Reaktion vid +pol
(Reduktion)
(Reduktion)
| 3. |
De två tillförda elektronerna [2e-] reducerar blydioxiden som delas upp i en blyjon(II)
och två syrejoner: [2e-] + PbO2 → Pb2+ + 2O2- |
| 4. |
Blyjonen från [3] reagerar med svavelsyran och bildar blysulfat varvid ytterligare två vätejoner frigörs: Pb2+ + H2SO4 → PbSO4 + 2H+ |
| 5. |
Vätejonerna från [2] och [4] förenas med syrejonerna från [3] och bildar två vattenmolekyler: 2H+ + 2H+ + 2O2- → 2H2O |